Alguna vez te has preguntado ¿por qué algunas reacciones químicas suceden en un abrir y cerrar de ojos, mientras que otras tardan horas, días, o incluso años? La respuesta se encuentra en la velocidad de reacción. No es solo cuestión de magia o misterio, sino de una serie de factores que influyen en lo rápido o lento que ocurren las transformaciones químicas. En esencia, la velocidad de reacción nos dice qué tan rápido se consumen los reactivos y se forman los productos en una reacción química. Imagina cocinar: ¿preparas un huevo frito en segundos o en horas? La velocidad a la que se cocina el huevo es análoga a la velocidad de una reacción química. En este artículo, exploraremos a fondo este concepto, analizando los factores que lo determinan y presentando ejemplos concretos para que puedas entenderlo de manera clara y sencilla.
Factores que Influyen en la Velocidad de Reacción
Ahora que tenemos una idea general de qué es la velocidad de reacción, vamos a adentrarnos en los factores que la gobiernan. Piensa en ello como una receta de cocina: si cambias los ingredientes o la temperatura, el resultado final será diferente. Lo mismo ocurre con las reacciones químicas. Estos factores son como las «llaves» que aceleran o frenan el proceso.
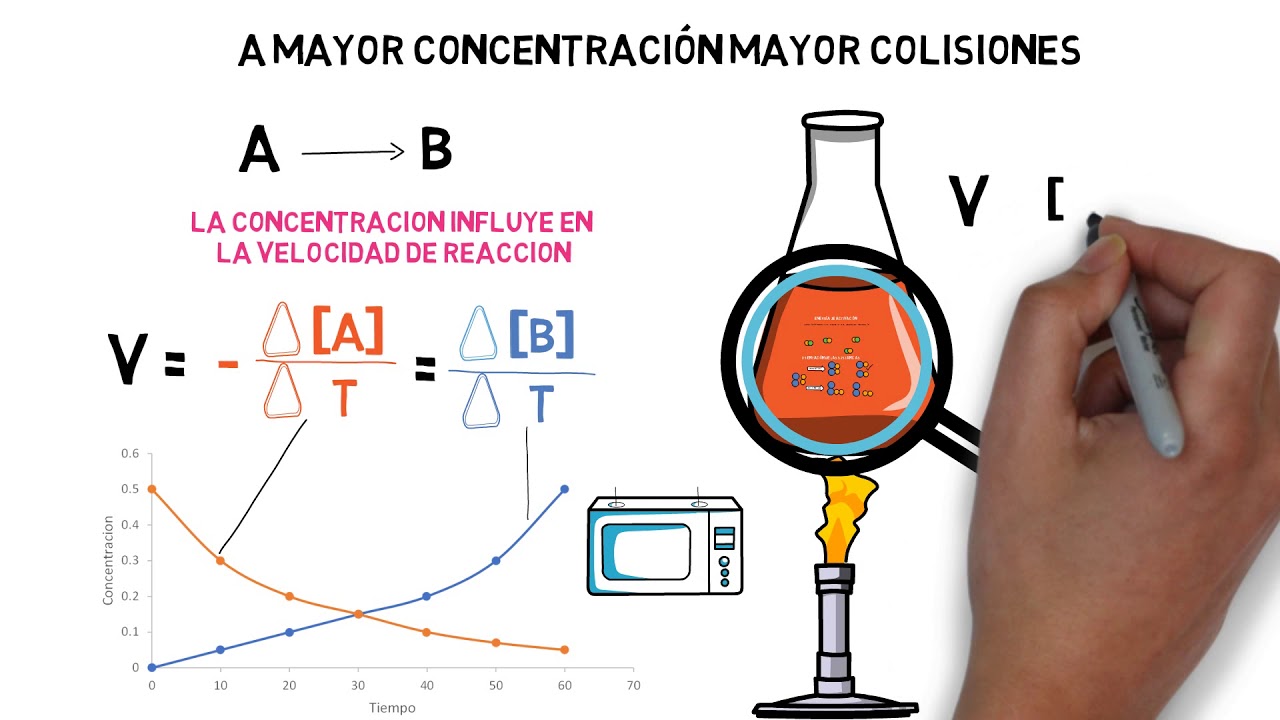
Concentración de los Reactivos
¿Alguna vez has intentado encender un fuego con un solo fósforo? Probablemente no fue fácil. Pero si usas varios fósforos juntos, la probabilidad de éxito aumenta considerablemente. Esto se debe a que una mayor concentración de reactivos (en este caso, el fósforo y el oxígeno) significa más choques entre las moléculas, lo que aumenta la probabilidad de que ocurra la reacción. Cuanto más concentrados estén los reactivos, más rápida será la reacción. Es como una fiesta: cuanta más gente hay, más probable es que se produzcan interacciones.
Temperatura
El calor es como el combustible de muchas reacciones químicas. Al aumentar la temperatura, las moléculas se mueven más rápido y con mayor energía cinética. Esto significa que hay más choques efectivos entre las moléculas, lo que incrementa la velocidad de reacción. Imagina una bola de billar: cuanto más rápido se mueve, más fuerte será el impacto cuando choque con otra bola. De manera similar, las moléculas a altas temperaturas tienen más energía para romper los enlaces y formar nuevos, acelerando la reacción.
Superficie de Contacto
Si quieres disolver una pastilla efervescente rápidamente, ¿la dejarías entera o la romperías en pequeños trozos? La respuesta es obvia: en pequeños trozos. Al aumentar la superficie de contacto entre los reactivos, aumenta el número de choques entre las moléculas, acelerando la reacción. Es como tener una conversación: es más fácil si estás cerca de la otra persona que si estás a kilómetros de distancia. Una mayor superficie de contacto significa más «oportunidades» para que las moléculas reaccionen.
Catalizadores
Los catalizadores son como los «ayudantes» en una reacción química. Estos compuestos especiales no se consumen durante la reacción, pero aceleran significativamente su velocidad. Lo hacen proporcionando un camino alternativo con una menor energía de activación, es decir, reduciendo la «barrera» que las moléculas deben superar para reaccionar. Piensa en ellos como un atajo en un viaje: llegas al destino más rápido sin gastar más energía. Los catalizadores son cruciales en muchos procesos industriales y biológicos.
Naturaleza de los Reactivos
La propia naturaleza de los reactivos también influye en la velocidad de reacción. Algunas sustancias reaccionan más fácilmente que otras. Por ejemplo, los metales alcalinos reaccionan violentamente con el agua, mientras que otros metales lo hacen más lentamente o incluso no reaccionan. Esto se debe a las diferencias en sus propiedades químicas, como la electronegatividad y la energía de enlace.
Ejemplos de Velocidades de Reacción
Para que todo esto sea más tangible, veamos algunos ejemplos concretos:
- Explosión de la dinamita: Una reacción extremadamente rápida, donde la liberación de energía es casi instantánea.
- Oxidación del hierro (herrumbre): Una reacción lenta que puede tardar meses o incluso años en completarse.
- Combustión de la madera: Una reacción relativamente rápida, donde la madera se quema en presencia de oxígeno.
- Fotosíntesis: Un proceso relativamente lento que ocurre en las plantas, donde la energía solar se utiliza para convertir dióxido de carbono y agua en glucosa y oxígeno.
Como puedes ver, la velocidad de reacción varía enormemente dependiendo de los factores que hemos discutido. Entender estos factores es crucial en muchas áreas, desde la industria química hasta la biología y la medicina.
Aplicaciones de la Velocidad de Reacción
El conocimiento de la velocidad de reacción no se limita a los laboratorios de química. Tiene aplicaciones prácticas en una gran variedad de campos:
Industria Química
En la industria química, el control de la velocidad de reacción es fundamental para optimizar los procesos de producción. Se utilizan catalizadores y se ajustan las condiciones de reacción (temperatura, presión, concentración) para maximizar el rendimiento y minimizar los costos. Imagina la producción de plásticos, fertilizantes o medicamentos: la velocidad de reacción determina la eficiencia y la rentabilidad del proceso.
Biología y Medicina
En biología y medicina, la velocidad de reacción es crucial para comprender los procesos metabólicos del cuerpo. Las enzimas, que son catalizadores biológicos, regulan la velocidad de las reacciones químicas en las células. El estudio de la cinética enzimática es fundamental para el desarrollo de fármacos y el tratamiento de enfermedades.
Ingeniería
En ingeniería, la velocidad de reacción es importante en el diseño de materiales y procesos. Por ejemplo, en la corrosión de metales, la velocidad de reacción determina la vida útil de las estructuras. Entender y controlar la velocidad de reacción es clave para la creación de materiales más resistentes y duraderos.
Ciencia de los Alimentos
En la ciencia de los alimentos, la velocidad de reacción influye en la calidad y la vida útil de los productos. La oxidación de las grasas, la fermentación de los alimentos, y la descomposición de los productos son ejemplos de procesos químicos cuya velocidad de reacción se busca controlar para preservar la calidad y seguridad de los alimentos.
- ¿Cómo se mide la velocidad de reacción? La velocidad de reacción se mide generalmente determinando la disminución de la concentración de los reactivos o el aumento de la concentración de los productos en un período de tiempo determinado. Existen diferentes métodos para hacerlo, dependiendo de la reacción en cuestión.
- ¿Qué es la energía de activación? La energía de activación es la energía mínima que deben poseer las moléculas para que se produzca una reacción química. Es como la «barrera» que deben superar las moléculas para reaccionar. Los catalizadores reducen la energía de activación, acelerando la reacción.
- ¿Existen reacciones que no tienen una velocidad de reacción? En realidad, todas las reacciones químicas tienen una velocidad de reacción, aunque algunas sean extremadamente lentas. Lo que puede variar es la escala de tiempo en la que se observa la reacción.
- ¿Cómo puedo predecir la velocidad de una reacción? La predicción precisa de la velocidad de una reacción requiere un conocimiento profundo de la cinética química y el uso de ecuaciones cinéticas. Sin embargo, un análisis cualitativo puede hacerse considerando los factores que hemos discutido anteriormente.
- ¿Qué diferencia hay entre velocidad de reacción y equilibrio químico? La velocidad de reacción se refiere a la rapidez con que se alcanza el equilibrio, mientras que el equilibrio químico describe el estado en el que las velocidades de la reacción directa e inversa son iguales.